Les études non thérapeutiques
Qu’est-ce qu'une étude non thérapeutique ?+
Les études non thérapeutiques regroupent un grand nombre de recherches de nature différente. Elles ont toutes pour point commun de ne pas porter directement sur l’utilisation d’un médicament.
Ainsi, trois grandes catégories de recherche sont concernées par cet ensemble : la recherche épidémiologique, la recherche en soins courants et la recherche translationnelle.
La recherche épidémiologique
Cette discipline s’attache à identifier les facteurs influençant la santé d’une population ou à évaluer l’impact d’une politique de santé sur une population ciblée.A ce jour, les recherches épidémiologiques menées dans le domaine des maladies hémorragiques ont permis, par exemple, d’évaluer le risque de développer un inhibiteur dans les traitements anti-hémophiliques, ou encore, d’identifier des paramètres importants comme l’intensité des traitements et le type de mutation à l’origine de la maladie.Ces études s’appuient sur des données collectées dans le dossier médical des patients (âge, sexe, pathologies, résultats biologiques, traitements, etc.), et parfois complétées des informations non cliniques (facteurs socio-économiques, psychologiques, géographique, etc.), rassemblées dans des bases de données. Celles-ci peuvent être élaborées spécifiquement pour une étude épidémiologique dans un temps donné sur un échantillon représentatif d’une population définie.
Ces études peuvent aussi s’appuyer sur des données extraites de bases de données bien plus larges comme par exemple FranceCoag.
Dans le domaine des maladies rares, l’inclusion des patients dans les recherches épidémiologiques doit être la plus étendue possible. Ainsi, en 2016, 85% des centres de la filière ont contribué à des études épidémiologiques.
La recherche en soins courants
Les progrès en médecine ne peuvent pas se limiter à la mise en place de nouvelles thérapies. Ils doivent aussi permettre une meilleure efficacité dans la prise en charge du patient et de ses proches. Cette catégorie de recherche, visant à améliorer la qualité des prises en charge et des soins apportés aux patients avec les moyens thérapeutiques, matériels et humains existants, s’est progressivement imposée comme étant nécessaire dans un contexte économique actuellement difficile. Elle devrait continuer à prendre une place majeure dans la recherche avec notamment l’évolution et la diversification des traitements.
En 2016, 66% des centres de la filière ont participés à ce type de recherche.
La recherche translationnelle
La recherche translationnelle est une recherche de transfert de connaissances, de méthodologies et de techniques entre la recherche fondamentale et la recherche clinique. Elle implique une collaboration entre chercheurs et médecins de disciplines parfois très différentes. Elle permet un enrichissement des champs d’investigation en recherche fondamentale tout en favorisant le progrès médical et l’émergence d’applications cliniques. Par exemple, la recherche en matière d’amélioration du diagnostic progresse actuellement à grands pas grâce à ce type de recherche.
La majorité des essais thérapeutiques sont le résultat de recherches translationnelles.
En 2016, 54% des centres de la filière participaient à des projets de recherche translationnelle.
Financements+
En recherche clinique, l’investigateur, le propriétaire des données et le financeur du projet de recherche sont très souvent la même personne physique ou morale que l’on nomme « promoteur ».
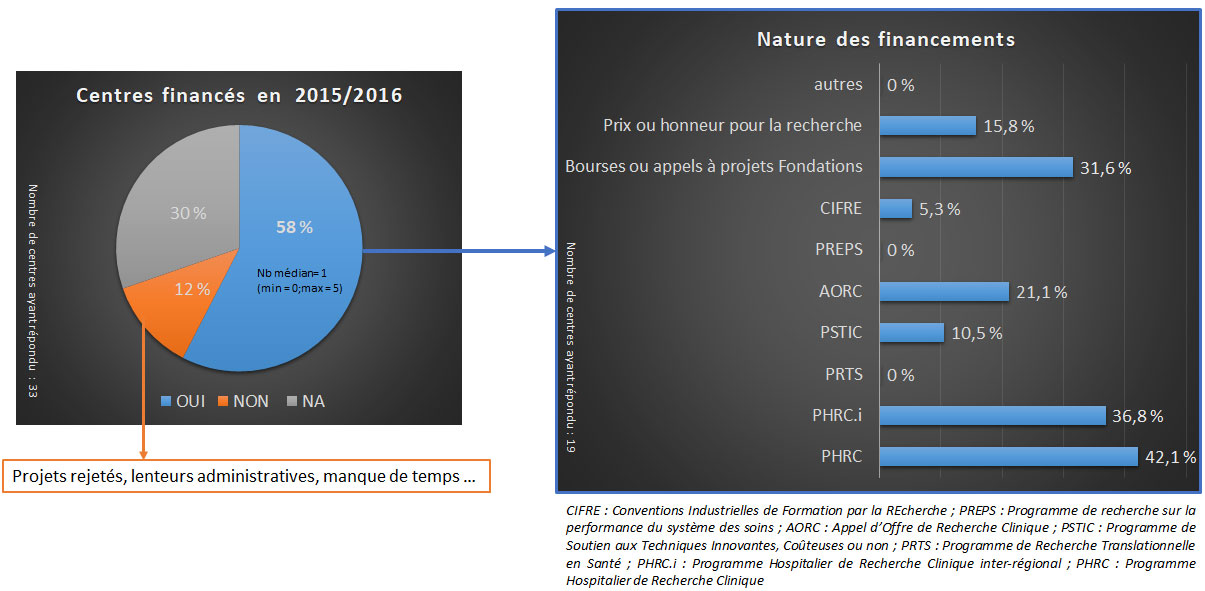
En 2015 et 2016, 58% des centres d’hémostase en France ont obtenu un financement pour au minimum un projet de recherche. La grande majorité des financements provenait de fonds publics à travers des Programmes Hospitaliers de Recherche Clinique nationaux (PHRC) ou inter-régionaux (PHRC.i), et dans une moindre mesure, des programmes financés par l’hôpital.
En épidémiologie, 71% des centres participent à des projets à promotion industrielle et 75% à promotion institutionnelle publique. Les registres, dont la fonction dépasse souvent la simple utilité dans un seul projet de recherche, sont historiquement financés par des fonds publics provenant par exemple de la Direction Générale de l’Offre de Soins (DGOS). Cependant, des études spécifiques utilisant une partie des données du registre peuvent être financées par des fonds d’origine diverse (privés et industriels). Les associations de patients comme l’Association française des hémophiles (AFH), ou des fondations comme la Fondation Maladie Rare (FMR), participent également au financement de ce type d’étude par l’intermédiaire d’appels à projet, ou par le financement de bourse d’étude doctorale ou post-doctorale.
Dans le domaine des soins courants, l’origine des financements reste également équilibrée entre les fonds publics et les fonds industriels. En revanche, la recherche translationnelle repose majoritairement sur des fonds publics. Cependant, la complexité croissante de ces projets s’accompagne de financements composites reflétant la diversité des collaborateurs impliqués dans les projets translationnels.
Participer à une étude non thérapeutique+
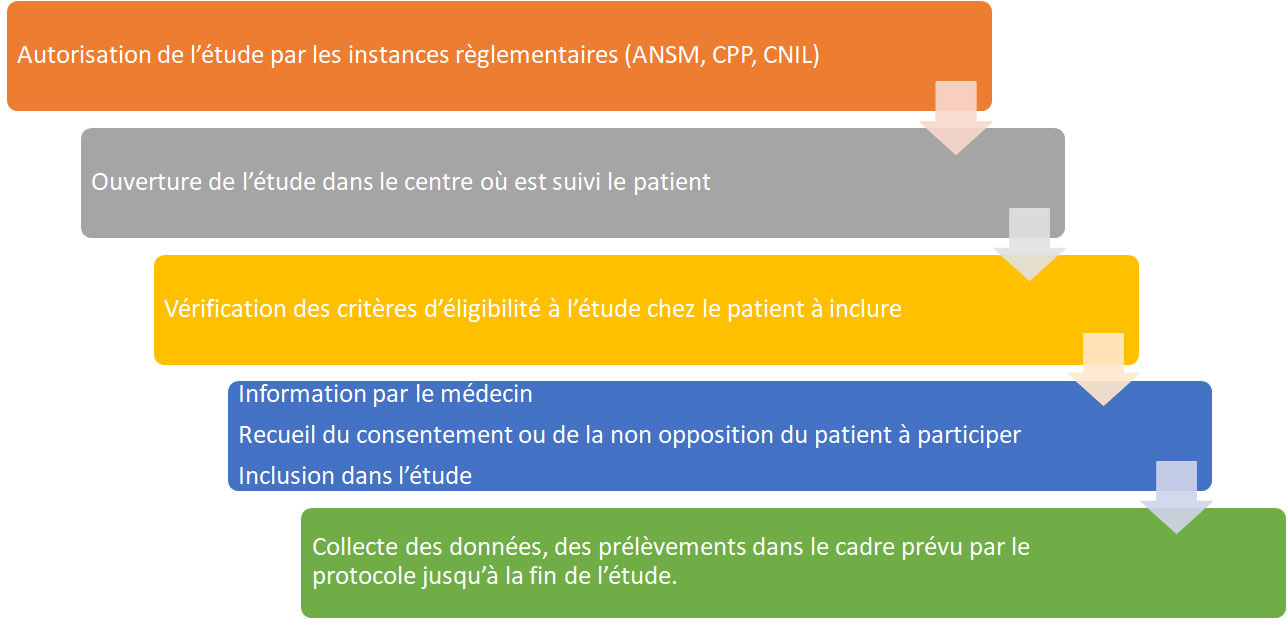
Pour débuter les inclusions dans un centre, les autorisations réglementaires nécessaires sont les suivantes :
L’avis favorable du Comité de Protection des Personnes (délai de réponse : 45 jours)
Le récépissé de la déclaration de conformité à la méthodologie de référence de la CNIL (délai de réponse : 2 mois)
L’Agence Nationale de Sécurité du Médicament et des produits de santé (ANSM), doit être aussi informée de l’étude, même si son autorisation est nécessaire seulement pour les essais portants sur des agents thérapeutiques.
A l’issue de ces démarches réglementaires, l’étude peut démarrer en France. Certaines études ne portent que sur des patients d’un centre (étude monocentrique), d’autres permettent l’inclusion de patients dans plusieurs centres (étude multicentrique).
Lorsque l’étude est multicentrique, les médecins responsables de l’étude dans chaque centre peuvent proposer aux patients réunissant tous les critères d’éligibilité au protocole de recherche, d’y participer. En ce cas, ils doivent informer le patient (et ses parents dans le cas des patients mineurs), de l’objet de l’étude, des objectifs, des éventuels bénéfices et des risques potentiels pour le patient ainsi que les contraintes imposées par le protocole (visites supplémentaires, prélèvements, hospitalisations, etc.).
Dans le cas où les données ou les échantillons sont déjà disponibles (dossier médical, biobanques déjà constituées, fonds de tubes, données non exploitées dans une étude précédente…), le patient (et les parents pour les enfants mineurs) doit, a minima, ne pas exprimer son opposition à la participation dans l’étude après avoir été informé par son médecin. Concernant les études prospectives portant sur la personne humaine, le patient doit consentir par écrit avant d’entamer toutes procédures au protocole.
A noter que les patients (et les parents) sont libres de retirer à tout moment leur consentement. Dès lors, la fin d’étude est alors anticipée.
L’autre raison d’une fin anticipée de l’étude peut être due à la découverte d’un risque inattendu d’évènement indésirable grave justifiant un arrêt prématuré de l’étude. Dans ce cas, le patient est informé des modalités de fin anticipée de l’étude pouvant inclure une ou plusieurs visites de contrôle.